НЕИНВАЗИВНАЯ ОПТИЧЕСКАЯ
И ЛАЗЕРНАЯ МЕДИЦИНСКАЯ
ДИАГНОСТИКА
(Неинвазивная медицинская спектрофотометрия, биоспектрофотометрия)
Это
новое диагностическое направление в
медицине,
зародившееся в конце 1980-х годов и
находящееся пока еще на этапах НИР, ОКР и
первых опытных образцов приборов во всем мире.
Оптическая неинвазивная
диагностика (ОНД) предполагает использование
оптического (в том числе лазерного)
излучения для прижизненного зондирования
тканей и органов пациента с целью получения
по отраженному (рассеянному, прошедшему
ткань насквозь и т.п.) свету диагностической
информации о биохимическом составе и
анатомическом (морфологическом) строении
обследуемого участка мягких тканей тела
пациента. Сегодня это под силу лишь
длительным по времени и дорогостоящим
лабораторным биохимическим и
гистологическим анализам, требующим взятия
образцов крови, фрагментов биотканей и т.п.,
или, частично, УЗИ и рентгенологическим
обследованиям. Оптическая диагностика во
многом позволяет решать эти задачи
неинвазивно, в реальном времени, более
дешевыми способами и без использования вредных
ионизирующих излучений (более подробно см.
статью Рогаткин Д.А., Лапаева Л.Г. «Перспективы
развития неинвазивной
спектрофотометрической диагностики в
медицине» // Медицинская техника, №4, 2003. –
с.31-36 а также нашу более раннюю постановочную статью
Рогаткин Д.А.
"Лазерная
клиническая диагностика как одно из
перспективных направлений биомедицинской
радиоэлектроники" // Биомедицинская
радиоэлектроника, №3, 1998. - с. 34-41.)
В основе применения оптических методов диагностики лежит тот факт, что все основные биохимические и клеточные компоненты тканей и крови обладают характерными "индивидуальными" спектрами поглощения, отражения, рассеяния и люминесценции. Эти спектры различны для разных мягких тканей и областей уплотнений в них, для окисленного и восстановленного состояния молекул в клетках ткани. Общее же процентное соотношение разных биохимических и анатомо-морфологических компонент в тканях различно для состояния нормы и заболевания органов и систем организма. Следовательно, общее функциональное и патофизиологическое состояние тканей отражается на их общих оптических свойствах, которые могут быть зарегистрированы методами лазерного спектрального анализа, спектроскопии рассеяния и поглощения и т.п. Современное развитие оптики, электроники и компьютерной техники позволяет проводить такую диагностику чрезкожно (in vivo, in situ) и в реальном масштабе времени. Вследствие того, что оптические свойства живых тканей зависят, главным образом, от содержания в тканях различных биохимических оптических хромофоров и флюорофоров (гемоглобина крови, меланина, порфирина и т.д.), данные диагностические методы (за исключением методов лазерной когерентной и диффузионной томографии - см. ниже) оказываются родственны обычным методам лабораторных клинических анализов за исключением преимуществ прижизненности измерений. Именно поэтому большинство диагностических методов оптической и лазерной неинвазивной медицинской диагностики можно и правильно будет именовать одним единым и обобщенным термином "неинвазивная медицинская спектрофотометрия" или просто "биоспектрофотометрия".
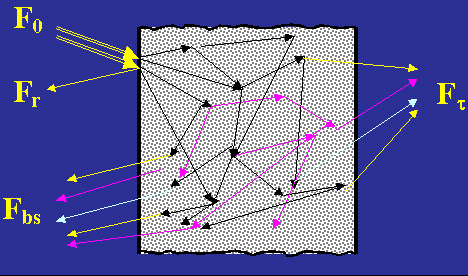
Для реализации всех этих методов обследуемая биологическая ткань освещается низкоинтенсивным оптическим излучением F0 разного спектрального состава, которое, проходя внутрь ткани, поглощается содержащимися в тканях хромофорами и рассеивается на внутренних неоднородностях среды (рис.1).

Рис.1.
В результате процессов внутреннего светорассеяния и отражения с фронтальной и тыльной поверхностей биоткани выходят вторичные потоки излучения Fi, содержащие информацию о внутренней структуре биоткани и о наличии в ней различных биологических молекул и анатомо-морфологических структур, рассеивающих и поглощающих свет в различных спектральных диапазонах длин волн. Многие биологические молекулы обладают также способностью к вынужденной флюоресценции (иногда и фосфоресценции) под влиянием внешнего освещения, а рассеяние света на движущихся форменных элементах крови дополнительно приводит к доплеровским сдвигам частот оптического излучения. Все это существенно дополняет и обогащает получаемую врачом информацию об обследуемой биологической ткани, однако ее "извлечение" из регистрируемых приборами световых потоков Fi возможно лишь с привлечением серьезных методов физико-математической обработки данных. В основе этих методов сегодня, как правило, лежат математические модели линейного взаимодействия излучения и вещества - теория переноса и рассеяния света в мутных средах, теория дифракции света на неоднородностях среды, фотометрические модели и т.п.
Диагностические
приборы, реализующие все эти принципы,
представляют собой соединенные с
компьютером оптико-электронные узлы и
блоки, позволяющие освещать область тела
пациента низкоинтенсивным оптическим
излучением заданной мощности и
спектрального состава и регистрировать
выходящее из тканей пациента вторичное (рассеянное)
излучение. Очень часто в качестве
источников излучения используют лазеры,
вследствие чего в названии методов
диагностики может присутствовать
дополнительное определение «лазерная».
Рис.2.
Вся конечная обработка информации и решение обратных задач оптики светорассеивающих сред на основе математических расчетных алгоритмов происходят сегодня в компьютерах диагностических систем. Вычислительный процесс носит многоуровневый и многоступенчатый характер, от вычислений погонных оптических свойств обследуемой среды распространения излучения в соответствии с принятыми в системе расчетными моделями до оценки относительной концентрации (уровней накопления) в тканях и крови различных молекул и общей статистико-вероятностной медико-биологической интерпретации наблюдаемой комплексной клинической картины в терминах медицины.
Основные направления развития ОНД в медицине:
Сегодня
в мире развиваются несколько перспективных
направлений медицинской оптической
неинвазивной диагностики – лазерная
когерентная и диффузионная томография,
спектроскопия упругого рассеяния,
флюоресцентная диагностика, лазерная
доплеровская флоуметрия, тканевая
оксиметрия и ряд других направлений. Первые
опытные образцы приборов уже пробуют свой
выход на рынок медтехники.
Наиболее
развитыми на сегодняшний день и реально уже
дошедшими до рынка медтехники можно
считать методы и приборы оптической
пульсоксиметрии (пульсоксиметры),
которые позволяют измерять оптическими методами частоту пульса и
кислородную сатурацию (оксигенацию) артериальной крови.
Это весьма важно в задачах, например,
реаниматологии и анестезиологии. Датчики
пульсоксиметра встраиваются сегодня
практически во все современные модели
прикроватных мониторов. Можно также
встретить и приобрести на рынке медтехники
и отдельные приборы фирм Nonin Inc.
(США), ЗАО «Инвекор» (Россия) и др. по ценам
порядка 400-1200$ за один прибор в зависимости
от модели. Однако по данным представителей
названных фирм годовые объемы продаж этих
приборов у них колеблются пока в пределах
10-150 штук каждой модели в год, т. к.
функционально отдельные приборы ничем не
отличаются от приборов, встроенных в
прикроватные мониторы. Но у мониторов есть
существенные преимущества по количеству
других функций, которые также необходимы в
практике современной анестезиологии и реанимации.
Поэтому большинство клиник, при наличии
денег, предпочитают сегодня закупать
именно комплексные прикроватные мониторы.
Следующими
за пульсоксиметрами идут приборы
лазерной
доплеровской флоуметрии, позволяющие
измерять частотные ритмы и скорость
капиллярного кровотока в
микроциркуляторном русле биотканей.
Приборы выпускаются также рядом фирм («Перифлюкс»
(Швеция), «Трансоник» (США), «Лазма» (Россия)
и др.),
но объем их продаж существенно ниже
пульсоксиметров (на российском рынке 5-50 шт. у каждой фирмы в год),
т.к. они существенно дороже (от 2000$ для «ЛАКК-01»
(Россия) до 10000-20000$ для приборов других фирм),
но, главное, обладают еще рядом
методических недостатков – плохой
помехоустойчивостью, слабой проработкой
вопросов обработки и трактовки результатов
измерений и т.п. В большинстве стран они
имеют разрешение на применение в
медицинской практике пока лишь только в
целях научных исследований. Однако, по мере
решения указанных научных и методических
проблем эти приборы, очевидно, будут все
более и более востребованы обычными
учреждениями здравоохранения.
Очень
большой перспективой обладают методы лазерной
диффузионной томографии. Они
потенциально позволяют без использования
рентгена просвечивать лазером мягкие ткани
пациента и математическими методами
обработки изображений восстанавливать
картину внутренних неоднородностей
структуры биоткани. Наиболее эффективной
областью их применения может считаться
маммография. Если учесть, что проблемы
маммологического обследования женской
половины населения на предмет мастопатии
груди, карциномы и т.п. стоят весьма остро в
любой стране мира, то рынок такого
диагностического оборудования просто
может исчисляться сотнями миллионов
долларов. Сегодня, к сожалению, не все
научные проблемы оптической диффузионной
томографии решены до конца так, чтобы
диффузионные томографы могли выпускаться
серийно и быть широко востребованы
практической медициной. Но, по крайней мере,
один оптический маммограф, как первый
опытный образец, проходящий уже этап
клинических испытаний, сегодня известен –
маммограф “CTLM”
фирмы “Imaging Diagnostic
Systems, Inc.”
(США).
Очень
близко к диффузионной томографии стоят
методы
лазерной когерентной и
низкокогерентной томографии. Их особой
областью применения является прецизионное
сканирование верхних слоев тканей,
особенно слизистых оболочек органов,
например, в практике гинекологии или
гастроэнтерологии (при эндоскопических
обследованиях) с пространственным
разрешением на уровне 5-10 микрон на предмет
поиска молодых групп клеток
злокачественных новообразований в
слизистых оболочках органов, что наиболее
перспективно для целей онкологии.
Не
менее серьезными перспективами обладают
методы лазерной флюоресцентной
диагностики. Они базируются на анализе
характеристик наведенной флюоресценции в
биотканях при их освещении
низкоинтенсивным лазерным излучением
определенных длин волн. Их основной
областью применения также считается
онкология, однако, вследствие того, что
многие гнойные, раневые, ожоговые и т.п.
деструктивно-воспалительные процессы в
тканях также сопровождаются изменением
флюоресцентной активности клеток тканей,
область применения этих методов в медицине
существенно шире. Причем здесь можно
выделить два направления развития методов
лазерной флюоресцентной диагностики. Первое связано
с контрастированием опухолей экзогенными
флюоресцирующими веществами с целью
последующего выявления по контрасту
изображения невидимых глазом злокачественных
новообразований и их точных контуров по
поверхности ткани. А второе связано с
созданием более чувствительной аппаратуры,
реагирующей на эндогенную (природную)
флюоресценцию клеток ткани, что позволяет
осуществлять исследование накопления в
тканях природных флюорохромов –
флавиновых ферментов, порфирина и т.п. По обоим
направлениям ряд приборов сегодня также
выходит на рынок или проходит последние
этапы клинических испытаний. В этой связи
можно отметить американские системы
оптической биопсии типа «OBS/L»
(уже получили одобрение FDA),
немецкие лазерные флюороскопы “LF-302”,
польские аналогичные приборы и российские
системы «ЛЭСА» производства
фирмы «Биоспек». Правда, основные
области заявленных применений этих систем
флюоресцентной диагностики больше
относятся к первому направлению
диагностики, а второе, по эндогенной
флюоресценции, более перспективное,
в силу ряда нерешенных вопросов научно-методического
характера пока еще остается на
этапах НИР и НИОКР во всем мире.
Одна из интереснейших новых неинвазивных оптических диагностических технологий - оптическая тканевая оксиметрия. Она, как и пульсоксиметрия, базируется на разнице в оптических свойствах оксигенированных и де-оксигенированых фракций гемоглобина, но в отличие от пульсоксиметрии, не требует модуляции потока крови пульсовой волной и, соответственно, позволяет определять не артериальную, как в пульсоксиметрии, а смешанную артерио-венозную сатурацию оксигемоглобина в обследуем участке микроциркуляторного русла биоткани. Показания тканевых оксиметров ближе даже к венозной сатурации оксигемоглобина, поэтому совместно с технологией пульсоксиметрии тканевая оксиметрия позволяет определять потребление кислорода клетками ткани. Тканевые оксиметры (в т.ч. церебральные) работают в реальном времени и позволяют изучать физиологические ритмы и динамику процессов в системе микроциркуляции и транспорта кислорода в тканях при различных функциональных нагрузочных тестах - окклюзионном, тепловом, лекарственном и пр.
Много
публикаций в научной литературе
встречается по методам и прибором для
фотоплетизмографии
– технологии, родственной пульсоксиметрии,
когда по графикам пульсовых волн
периферического кровообращения,
полученным оптическими методами, анализируются
частотные ритмы кровотока, представляющие
собой сложный комплекс ритмов,
составленный из кардиоритма, дыхательного
ритма, суточного ритма активности, ритма
вазомоторных колебаний стенок сосудов и т.д.
Технология очень перспективна при
наблюдении больных, страдающих сердечно-сосудистыми
заболеваниями, однако реальные приборы для фотоплетизмографии с разработанными
методами количественной оценки данных пока
на рынке медтехники встречаются редко.
Проходящие
ежегодно мировые научные конференции по
проблематике оптической и лазерной
неинвазивной диагностики в медицине
доносят сведения о попытках разработки и
других приборов и методов, например, для
определения содержания жира в тканях,
холестерина, каратиноидов, сахара в крови и
т.п. Последнее направление работ наиболее
привлекательно для решения проблемы
диабета, т.к. в случае создания портативных
и недорогих неинвазивных приборов контроля
уровня сахара в крови рынок этих приборов
может достигать сотен миллионов долларов
год за счет массовой продажи их населению (в мире
насчитывается более 250 млн. диабетиков).
Поэтому, десятки фирм по всему миру ищут
решение этой проблемы и тратят на
исследования огромные средства. К
сожалению, сложности с точным
количественным определением содержания
многих биохимических компонент в тканях
сегодня пока им преодолеть не удается и
реальных портативных приборов в этом
направлении на рынке медицинской техники
пока встретить не удалось. Однако имеются все основания
предположить, что в самое ближайшее время
такие приборы на рынке начнут
появляться.
Особенности получаемой с помощью неинвазивной спектрофотометрии медицинской информации см. дополнительно в разделе "Медицинские аспекты...".
Назад в "Наше творчество"... На главную страницу....